Índice
Qué es la medicina genómica
La genómica es el estudio de todos los genes (ADN) de una persona, incluidas las interacciones de esos genes entre sí y con el entorno. Al conjunto de ADN de un organismo se le denomina genoma. Por su parte, la medicina genómica es el campo de estudio que analiza los genes y su interacción con la salud. La medicina genómica implica la investigación de los complejos detalles biológicos del ser humano y el uso de estos datos para un diagnóstico efectivo y un tratamiento personalizado.
Prácticamente, cada célula del cuerpo contiene una copia completa de los aproximadamente 3 mil millones de pares de bases de ADN que conforman el genoma humano.
El ADN contiene la información necesaria para construir todo el cuerpo. Un gen se refiere tradicionalmente a la unidad de ADN que contiene las instrucciones para elaborar una proteína específica o un conjunto de proteínas. Cada uno de los 20 mil a 25 mil genes estimados en el genoma humano codifica un promedio de tres proteínas.
Ubicados en 23 pares de cromosomas empaquetados en el núcleo de una célula humana, los genes dirigen la producción de proteínas con la ayuda de enzimas y moléculas mensajeras. Las proteínas conforman estructuras corporales como los órganos y tejidos. Además, controlan las reacciones químicas y transmiten señales entre las células. Si el ADN de una célula está mutado, se puede producir una proteína anormal. Como resultado, se puede interrumpir los procesos habituales del cuerpo y provocar una enfermedad.
En la actualidad, la medicina genómica está teniendo un impacto en los campos de la oncología, farmacología, enfermedades raras y no diagnosticadas, y enfermedades infecciosas.
Antecedentes: Proyecto Genoma Humano
El Proyecto Genoma Humano (HGP, por sus siglas en inglés) fue un esfuerzo público y privado que comenzó en 1990 para mapear la secuencia completa del ADN humano. Los líderes del proyecto creían que la identificación de la estructura del ADN humano brindaría información sobre sus funciones. En particular, las relacionadas con la salud y las enfermedades.
La inversión en el Proyecto Genoma Humano se basó en la expectativa de que el conocimiento generado se utilizaría para mejorar nuestra comprensión de la biología y las enfermedades, y para mejorar la salud. En los años transcurridos desde la finalización del Proyecto Genoma Humano, ha habido mucha expectativa sobre la inicialmente llamada medicina personalizada. La Academia Nacional de Ciencias solicitó la actualización del término por “medicina de precisión“, donde se utilizaría genómica, epigenómica, exposición ambiental y otros datos para guiar con mayor certeza el diagnóstico individual. La medicina genómica, como se definió anteriormente, puede considerarse un subconjunto de la medicina de precisión.
La aplicación de nuevos descubrimientos en la atención clínica puede tardar muchos años. Sobre la base de los descubrimientos de los últimos cinco a 10 años, la medicina genómica está comenzando a impulsar nuevos enfoques en ciertas especialidades médicas. La oncología, en particular, está a la vanguardia de la incorporación de la genómica. Esto porque los diagnósticos para marcadores genéticos y genómicos se incluyen cada vez más en la detección del cáncer y en la definición de tratamientos adaptados.
Tal vez te pueda interesar: El microbioma humano, la contraparte del genoma humano
Aportaciones de la medicina genómica
Mientras que la genética analiza genes específicos o grupos de “letras” a lo largo de la cadena de ADN, la genómica se refiere al estudio de la composición genética completa de alguien. Se trata de cómo se relacionan y reaccionan los genes entre sí y su relación con enfermedades que tienen una amplia gama de desencadenantes. Por ejemplo, la diabetes, enfermedades cardíacas, cáncer y asma. La medicina genómica puede ayudar de muchas maneras:
- Diagnóstico: cuando la causa de una variedad de síntomas no puede identificarse por ningún otro medio.
- Pruebas prenatales: para la detección, en caso de que algo esté mal con el bebé, o cuando haya antecedentes familiares. Ayuda a los padres a tomar decisiones y planes informados para el futuro.
- Antecedentes familiares de trastornos genéticos graves: es posible indicar a los futuros padres si son portadores de alguna enfermedad o no y si pueden transmitirla a sus hijos. También puede decirle a alguien si es probable que desarrolle la condición hereditaria más adelante en la vida, incluso si aún no tiene ningún síntoma.
- Evaluación de riesgos: la composición genética de alguien puede mostrar la susceptibilidad a padecer ciertas enfermedades. Por ejemplo, enfermedades cardíacas, accidentes cerebrovasculares y cáncer. Asimismo, la probabilidad de que tengan niveles altos de colesterol o que sufran problemas venosos. Poseer este conocimiento significa que se puede manejar el riesgo a través de medicamentos, intervención médica o haciendo cambios en el estilo de vida.
Tal vez te pueda interesar: Diagnóstico molecular, tendencia y futuro de la atención médica
Investigación y aplicación de la medicina genómica
Los avances en tecnología genética están teniendo un gran impacto en la clínica. Las pruebas genómicas traen consigo una mayor oportunidad para el diagnóstico o predicciones de diagnósticos futuros. No obstante, también implican una mayor posibilidad de hallazgos inciertos o inesperados.
En el pasado, las pruebas genéticas rara vez podían proporcionar resultados rápidos. Ahora, la creciente velocidad y disponibilidad de las pruebas genómicas está cambiando esta realidad. La información genómica influye cada vez más en las decisiones sobre la atención del paciente en el contexto de pacientes hospitalizados con condiciones agudas.
Se estima que en promedio, se necesita 17 años para llevar un hallazgo de investigación a la práctica clínica de rutina. Este retraso se debe a una combinación de factores. Por ejemplo, la necesidad de validar los descubrimientos de la investigación o el hecho de que los ensayos clínicos son complejos y toma tiempo realizarlos y analizarlos. Además, porque divulgar información y educar a los trabajadores de la salud sobre un nuevo avance no es un proceso inmediato.
Una vez que se ha generado evidencia suficiente para demostrar un beneficio para los pacientes o la utilidad clínica, los profesionales de la salud y los grupos de estándares clínicos usan esa evidencia para determinar si se debe incorporar el hallazgo en las guías de práctica clínica. Esta determinación también tendrá en cuenta los posibles problemas éticos y legales, así como factores económicos como las relaciones costo beneficio.
Entendiendo los nuevos descubrimientos en medicina genómica
El Grupo de Trabajo de Medicina Genómica del Instituto Nacional de Investigación del Genoma Humano de Estados Unidos (NHGRI, por sus siglas en inglés) ha reunido a partes interesadas para discutir temas relacionados con la adopción de la medicina genómica. En particular, el grupo obtiene la experiencia de los investigadores a la vanguardia de la medicina genómica. Además, el grupo de trabajo proporciona orientación al Consejo Consultivo Nacional sobre Investigación del Genoma Humano (NACHGR) y al NHGRI, en otras áreas de la implementación de la medicina genómica. Por ejemplo, cómo esbozar las necesidades de infraestructura para la adopción de la medicina genómica, así como identificar los esfuerzos relacionados para futuras colaboraciones y revisar el progreso general en la implementación de la medicina genómica.
La causa exacta de muchas enfermedades genéticas sigue siendo desconocida. Para algunos pacientes, el problema puede atribuirse a errores en el ADN o cambios en los genes que pueden provocar enfermedades raras y graves. La investigación emergente en medicina genómica está trabajando para abordar los errores subyacentes en el ADN que conducen a algunas enfermedades genéticas.
Existen preguntas frecuentes sobre el campo emergente de la medicina genómica que se responde a continuación. Esto incluye la terapia génica, la edición del genoma y la terapia celular. Asimismo, se explica brevemente lo que estas tecnologías podrían significar para el tratamiento de enfermedades raras.
Qué es la terapia génica
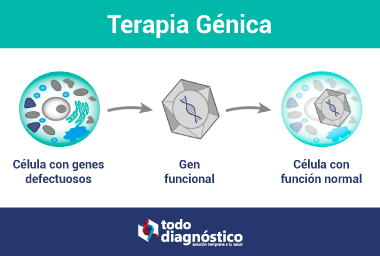 La terapia génica es el tratamiento de una enfermedad particular, administrando un nuevo gen en las células del paciente para reemplazar un gen incorrecto o dañado. La mayoría de las veces, la terapia génica funciona al introducir una copia corregida de un gen defectuoso en las células del individuo, sin eliminar o modificar el gen defectuoso. El objetivo de la terapia génica es tratar o curar una enfermedad genética agregando una copia normal del gen responsable de la enfermedad.
La terapia génica es el tratamiento de una enfermedad particular, administrando un nuevo gen en las células del paciente para reemplazar un gen incorrecto o dañado. La mayoría de las veces, la terapia génica funciona al introducir una copia corregida de un gen defectuoso en las células del individuo, sin eliminar o modificar el gen defectuoso. El objetivo de la terapia génica es tratar o curar una enfermedad genética agregando una copia normal del gen responsable de la enfermedad.
Aunque el concepto parece futurista, la terapia génica ha sido estudiada por muchos investigadores durante más de 40 años. A lo largo del camino se ha prestado mucha atención a garantizar que esta tecnología compleja se implemente de manera segura y efectiva.
Qué es la edición del genoma
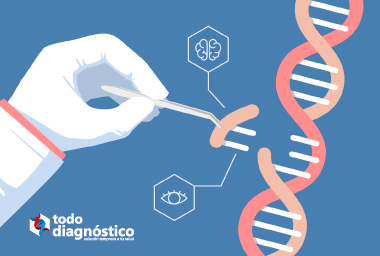
La edición del genoma o edición genómica realiza cambios permanentes en el código genético de una célula. Esto mediante corregir, deshabilitar, eliminar o modificar el ADN.
La edición del genoma funciona con enzimas llamadas nucleasas de diseño o nucleasas sitio-dirigidas. Su función consiste en hacer cortes precisos en secuencias específicas de ADN. Con estas nucleasas de diseño, el ADN de una célula puede cambiarse permanentemente. Hay varios tipos de nucleasas de diseño utilizadas en la edición del genoma. Estas incluyen:
- Nucleasas con dedo de zinc (ZFN)
- Nucleasas tipo activadores de transcripción (TALEN)
- Repeticiones palindrómicas cortas agrupadas con intervalos regulares (CRISPR)
Cada herramienta de edición del genoma tiene pequeñas diferencias. No obstante, todas las nucleasas diseñadas están formuladas para hacer lo mismo. Es decir, actuar como tijeras moleculares para cortar el ADN en un lugar preciso en el genoma para eliminar, agregar o reemplazar el ADN.
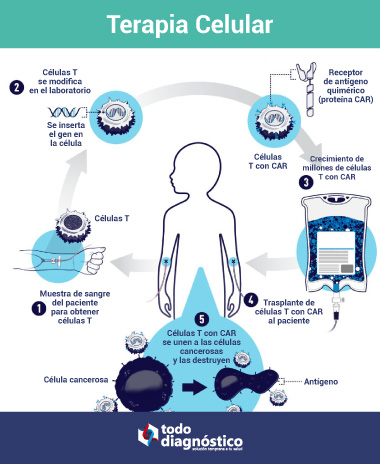 Qué es la terapia celular
Qué es la terapia celular
La terapia celular es la infusión o trasplante de células humanas a un paciente para el tratamiento de una enfermedad. El origen de las células puede ser del paciente o de un donante sano. Esta tecnología utiliza las propias células del paciente o del donante para brindar tratamiento a enfermedades causadas por errores en el ADN, infecciones o cáncer. Las transfusiones completas de sangre, glóbulos rojos, plaquetas, médula ósea y células T CAR, son todas formas de terapia celular.
¿Se puede combinar la edición del genoma y la terapia celular?
La edición del genoma y la terapia celular tienen el potencial de mitigar la causa subyacente de las enfermedades genéticas y se les puede combinar para ciertos tratamientos. Primero las células se recolecta del paciente o donante sano. Después se les modifica en un laboratorio utilizando la edición del genoma y se vuelve a administrar al paciente.
Actualmente se está investigando numerosos enfoques con una terapia prometedora que involucra un tipo de terapia celular llamada terapia de células T CAR. Con este tratamiento, las células T (tipo de célula inmune humana) se recolecta de la sangre y se modifica con nucleasas de diseño en el laboratorio. Esto con el fin de mejorarlas para atacar las células cancerosas. Posteriormente, se regresa las células modificadas al paciente.
El futuro de la medicina genómica
El panorama de opciones de tratamiento para enfermedades genéticas está cambiando. Esto tiene implicaciones evolutivas para las discusiones clínicas sobre trastornos no tratables en el pasado. Además, el punto de acceso a las pruebas está cambiando con el contacto directo con el consumidor fuera del entorno formal de atención médica.
El concepto general de medicina genómica está evolucionando. El estudio de las vías de mutación genética y sus variaciones es particularmente emocionante. ¿Pero qué significa esto para las personas en un nivel práctico?
Como se mencionó anteriormente, hay algunas enfermedades genéticas que son difíciles de diagnosticar debido a la amplia gama de genes involucrados. Los científicos están trabajando para encontrar un cuello de botella químico o genético para condiciones como estas.
Por otro lado, la tecnología de secuenciación de ADN ha mejorado tanto en profundidad, como en amplitud. Esto es especialmente relevante porque ha sido importante para comprender mejor el cáncer. La capacidad de secuenciar genomas de cáncer ha llevado a una rápida identificación de las mutaciones conductoras. Además, ha ayudado a resolver las complejas relaciones entre diferentes subclones de cáncer en el espacio y el tiempo, lo que demuestra la enorme heterogeneidad de los tipos de cáncer y la dificultad de tratarlos con éxito.
A medida que las tecnologías de secuenciación han avanzado hasta el nivel donde se puede secuenciar pequeñas cantidades de células tumorales o individuales, ha sido posible identificar mecanismos mutacionales previamente desconocidos, como la cromotripsis y la kataegis.
Al comprender lo que ya está escrito en nuestro código genético, podremos predecir y gestionar lo que sucederá en el futuro. Los nuevos avances en medicina genómica crean un entorno en el que se puede hacer planes preventivos para la salud, buscar asesoramiento y recibir tratamiento en las etapas iniciales vitales de la enfermedad.
 Tu opinión es importante
Tu opinión es importante
Nuestro objetivo en Todo Diagnóstico es informarte y ayudarte a tomar las mejores decisiones acerca de lo más valioso que tienes, tu salud y la de tus seres queridos. Hacemos un gran esfuerzo por presentar información de manera sencilla y fácil de entender. Finalmente, ayúdanos a saber si estamos haciendo bien nuestro trabajo. Califica nuestro artículo y/o deja un breve comentario.
Fuentes
NIH. (2018). Genomics and Medicine. 29 de mayo de 2019, de National Human Genome Research Institute Sitio web: https://www.genome.gov/health/Genomics-and-Medicine
Aetna Inc. (2017). What is genomic medicine? An introduction to genetics in health care. 29 de mayo de 2019, de Aetna Inc. Sitio web: https://www.aetnainternational.com/en/about-us/explore/future-health/what-is-genomic-medicine.html
Rachel H. Horton y Anneke M. Lucassen. (2019). Recent developments in genetic/genomic medicine. 29 de mayo de 2019, de Clinical Science Sitio web: http://www.clinsci.org/content/133/5/697
Sangamo Therapeutics. (2018). Understanding New Discoveries in Genomic Medicine. 29 de mayo de 2019, de Sangamo Therapeutics Sitio web: https://www.sangamo.com/application/files/1915/3548/1974/Resources_Article_2.pdf
Andrew P. Read. (2014). The Human Genome—Structure and Organization. 29 de mayo de 2019, de Oxford University Press Sitio web: https://oxfordmedicine.com/view/10.1093/med/9780199896028.001.0001/med-9780199896028-chapter-2
NIH. (2018). A Brief Guide to Genomics. 29 de mayo de 2019, de National Human Genome Research Institute Sitio web: https://www.genome.gov/about-genomics/fact-sheets/A-Brief-Guide-to-Genomics








1 comentario
Dónde se encuentran en el País México, localizadas las clínicas, ** Todo diagnóstico**